Phân tử là một phần kiến thức quan trọng mà chúng ta đã được học trong chương trình hoá học bậc Trung học cơ sở. Để giúp các bạn nắm rõ ràng và đầy đủ, bài viết sẽ hệ thống lại toàn bộ kiến thức về phân tử bao gồm phân tử là gì? Công thức tính phân tử khối và các kiến thức liên quan khác. Mời bạn theo dõi bài viết để cùng ôn lại phần kiến thức hoá học này nhé!
Tóm tắt
Phân tử là gì?
Năm 1811, phân tử lần đầu được nhắc đến bởi Avogadro. Khi mới xuất hiện thì khái niệm phân tử đã gây tranh ra nhiều cuộc tranh cãi trong cộng đồng hoá học. Mãi đến năm 1911, khi Perrin công khai kết quả nghiên cứu của mình thì từ đó thuyết phân tử hiện đại mới trở nên phổ biến.
Xem thêm: Nguyên tử là gì và các vấn đề liên quan đến nguyên tử

Phân tử là gì đã xuất hiện trong chương trình hóa học bậc THCS
Trong lý thuyết động học của khí chất, phân tử là định nghĩa được dùng cho mọi hạt khí, bất kể thành phần của nó. Theo đó, các nguyên tử khí trơ sẽ được coi là các phân tử đơn phân tử.
Ví dụ cụ thể để bạn hiểu rõ hơn phân tử là gì: Phân tử nước là sự kết hợp của hai nguyên tử Hydro (H) và 1 nguyên tử Oxy (O) và có công thức hoá học là H2O. Kích thước của các phân tử này siêu nhỏ, trong đó H chính là nguyên tử nhỏ nhất trong các nguyên tố. Do đó, nước thẩm thấu vào da cực dễ dàng. Hydro và Oxy có điện tích trái dấu nên các phân tử nước thường hút nhau bằng liên kết Hidro. Tuy nhiên, liên kết này rất dễ đứt gãy, không bền vững.
Một số các phân tử khác cũng rất phổ biến như Canxi Oxit (CaO), Ôzon (O3), Nitơ (N2), Glucozo (C6H12O6), Muối ăn (NaCl).
Một số khái niệm liên quan đến phân tử
Để hiểu đầy đủ và trọn vẹn phân tử là gì thì chúng ta phải biết cả những khái niệm liên quan đến phân tử. Dưới đây là một số khái niệm phổ biến xoay quanh kiến thức về phân tử:
Khoa học phân tử là gì?
Dựa vào việc đang hướng đến vật lý hay hóa học mà người ta coi khoa học phân tử là vật lý phân tử hay hóa học phân tử. Vật lý phân tử liên quan đến những định luật về cấu trúc, tính chất của phân tử. Trong khi đó, hóa học phân tử sẽ liên quan đến các định luật chi phối sự tương tác của phân tử làm phá vỡ hay hình thành các liên kết hóa học.
Thực tế, sự phân biệt về hai khái niệm trên còn khá mơ hồ. Trong khoa học phân tử, một phân tử sẽ bao gồm hai hoặc nhiều nguyên tử. Các ion phân tử có lúc sẽ được xem là hữu ích giống như các phân tử tích điện.
Khoa học phân tử có hai loại là vật lý phân tử và hoá học phân tử
Đại phân tử
Đại phân tử là các phân tử rất lớn được tạo ra bởi phản ứng trùng hợp của các đơn vị nhỏ hơn nó. Trong một đại phân tử thường chứa đến hàng ngàn, thậm chí chục ngàn nguyên tử.
Trong hoá sinh, một số đại phân tử thường gặp đó là polyme sinh học và polyme phi sinh học. Polyme sinh học có những cái tên như protein, cacbohidrat, axit nucleic và polyphenol. Polyme phi sinh học nổi bật là lipid và macrocycle. Các đại phân tử tổng gặp phổ biến bao gồm sợi tổng hợp, chất dẻo, vật liệu trong phòng thí nghiệm như ống nano cacbon.
Công thức phân tử là gì?
Công thức phân tử dùng để nói về một biểu thức cho biết số lượng và loại nguyên tử có trong phân tử của một chất. Ví dụ, có 6 nguyên tử Cacbon (C) và 14 nguyên tử Hydro (H) trong một phân tử hexan thì công thức phân tử sẽ là C6H14. Công thức và cấu trúc phân tử sẽ có vai trò quyết định đến tính chất và khả năng phản ứng của nó.
Liên kết phân tử là gì?
Liên kết hoá học có thể hiểu là sự hình thành liên kết giữa hai hoặc nhiều nguyên tử, phân tử, ion để tạo nên một hợp chất hoá học. Hợp chất hoá học phụ thuộc vào độ bền vững của các liên kết hoá học giữa các thành phần. Liên kết càng mạnh thì hợp chất được thành sẽ càng bền vững hơn. Có hai dạng liên kết giữa các phân tử đó là liên kết cộng hoá trị và liên kết ion, cụ thể:
Liên kết cộng hoá trị
Liên kết cộng hoá trị là một dạng phổ biến trong liên kết phân tử
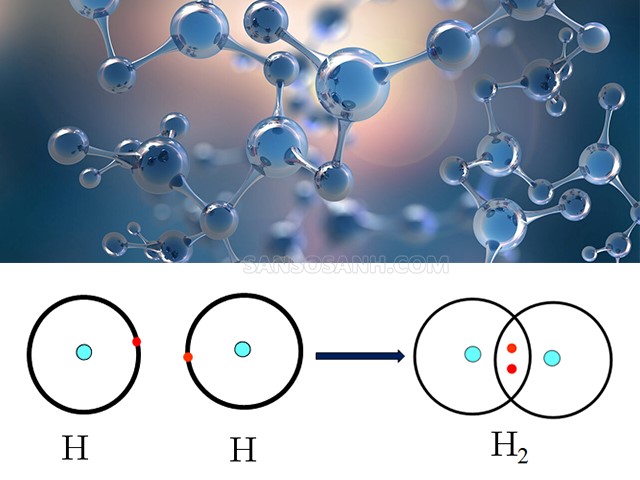
Đây là một dạng liên kết hoá học được tạo nên bằng việc sử dụng chung một hoặc nhiều cặp electron của các nguyên tử. Lực đẩy và lực hút giữa các nguyên tử trong khi chia sẻ các electron chính là liên kết cộng hoá trị. Mỗi một cặp electron chung sẽ tạo nên một liên kết cộng hoá trị. Liên kết cộng hoá trị bao gồm hai loại đó là phân cực và không phân cực:
- Liên kết cộng hoá trị phân cực là liên kết có cặp electron chung không bằng nhau, bị lệch hẳn về. Nguyên tử có độ âm điện lớn hơn thì lực hút sẽ mạnh hơn. Thế nên electron được chia sẻ gần nguyên tử có độ âm điện lớn hơn.
- Liên kết cộng hóa trị không phân cực là liên kết hình thành từ hai nguyên tử của một nguyên tố. Nó được tạo nên khi các nguyên tử chia sẻ electron bằng nhau. Một số ví dụ như N2, H2,...
Điểm chung của các hợp chất có liên kết cộng hóa trị là các phân tử này đều tồn tại được ở cả ba thể rắn, lỏng và khí. Các chất phân cực sẽ tan nhiều trong dung môi có cực và hầu hết các chất không cực sẽ tan trong dung môi không cực. Những chất có liên kết cộng hóa trị không phân cực đều không dẫn điện.
Liên kết ion
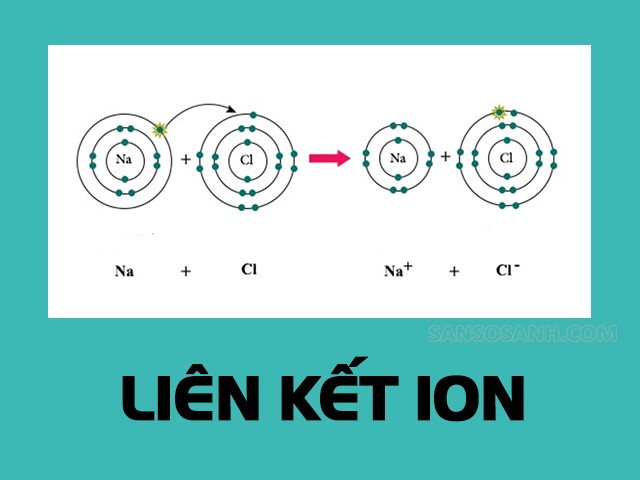
Liên kết ion là dạng liên kết được tạo nên từ các nguyên tử có độ âm điện khác nhau, khi các electron được chuyển từ nguyên tử này sang cho nguyên tử khác. Điều kiện cần thiết để tạo nên liên kết ion là hai phân tử khi phản ứng phải trái dấu với nhau.
Điều kiện để tạo nên liên kết ion là hai phân tử tham gia phải trái dấu nhau
Liên kết này được tạo thành giữa những nguyên tử nguyên tố phi kim điển hình và nguyên tử nguyên tố kim loại điển hình. Cation là tên gọi của các ion mang điện tích dương, còn Anion là các ion mang điện tích âm. Liên kết ion sẽ mang những đặc điểm chính sau:
- Chất rắn ion là dạng tinh thể và tồn tại ở nhiệt độ phòng.
- Hợp chất ion cứng sẽ có điểm sôi và điểm nóng chảy cao.
- Hợp chất ion dễ bị phá vỡ khi gặp áp lực.
- Chất rắn ion sẽ không dẫn điện, còn dung dịch ion có thể dẫn điện.
Phân tử có kích thước ra sao?
Đa phần các phân tử đều có kích thước siêu nhỏ, không thể nhìn thấy bằng mắt thường. Phân tử thường dùng để làm các khối xây dựng nhằm tổng hợp hữu cơ có kích thước từ một đến vài chục Angstroms hoặc khoảng một phần tỷ mét.
Những phân tử đơn lẻ sẽ không thể quan sát được bằng ánh sáng thường nhưng lại có thể sử dụng kính hiển vi lực nguyên tử để nhìn. Thiết bị này giúp chúng ta truy tìm được các phân tử nhỏ, thậm chí thấy cả đường viền của các nguyên tử đơn lẻ trong một số trường hợp.
Các phân tử lớn nhất sẽ có tên gọi là đại phân tử hoặc siêu phân tử. Phân tử nhỏ nhất trong các phân tử chính là Hydro diatomic (H2).
Phân tử khối là gì và cách để tính phân tử khối
Khái niệm phân tử khối
Phân tử khối là khối lượng của một nguyên tử theo đơn vị Cacbon (C). Phân tử khối của một chất nào đó sẽ bằng tổng nguyên tử khối của tất cả nguyên tử có trong phân tử đó. Ví dụ cụ thể: Phân tử khối của H2 sẽ là H = 1.2 = 2 (đvC).
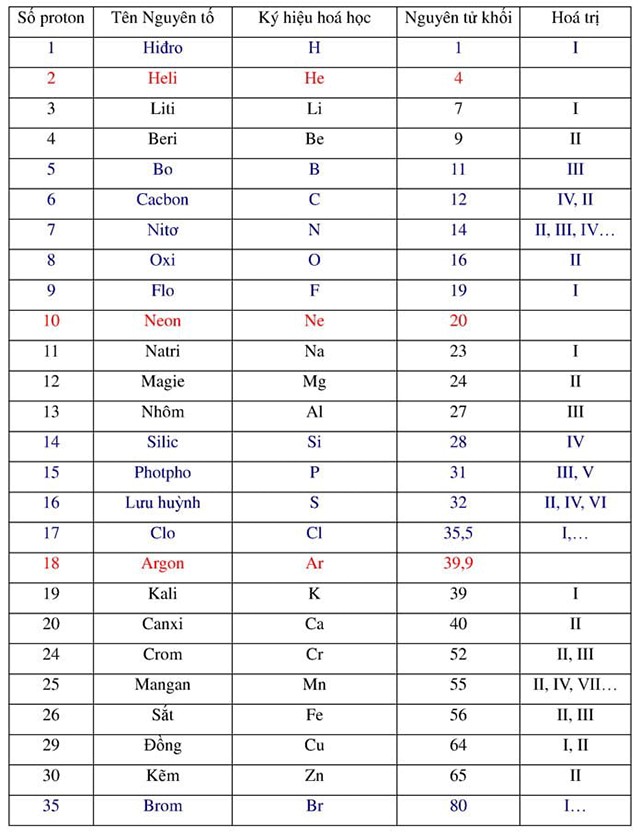
Dựa vào bảng nguyên tử khối của các nguyên tố để tính phân tử khối
Làm sao để tính phân tử khối?
Để tính phân tử khối bạn thực hiện theo 3 bước dưới đây:
- Hãy xác định nguyên tử khối dựa trên kí hiệu hoá học.
- Sau đó, lấy nguyên tử khối nhân với số nguyên tử của nguyên tố đó.
- Cộng tổng các số tích của nguyên tử khối đã làm ở bước thứ 2 lại với nhau là sẽ ra phân tử khối.
Công thức sẽ như sau:
Nếu một phân tử được tạo thành từ x nguyên tử A và y nguyên tử B thì bạn sẽ tính như sau:
PTK = a.x + b.y (a và b là nguyên tử khối của A và B)
Tương tự, đối với phân tử có nhiều nguyên tử hơn: x nguyên tử A, y nguyên tử B, z nguyên tử C sẽ là:
PTK = a.x + b.y + c.z (a, b và c lần lượt là nguyên tử khối của A, B và C)
Giờ thì bạn đã ôn lại được phân tử khối là gì và cách tính phân tử khối rồi đúng không. Hãy đọc đi đọc lại và áp dụng vào bài tập thực tế chắc chắn bạn sẽ thành thạo phần kiến thức này.
Điểm khác biệt giữa nguyên tử và phân tử là gì?
Nguyên tử là những hạt có kích thước siêu nhỏ và trung hòa về điện. Thành phần của nguyên tử gồm hạt nhân nguyên tử (Proton và Notron) và vỏ nguyên tử (Electron). Proton và Notron có khối lượng nặng hơn nhiều so với Electron. Khối lượng của nguyên tử sẽ bằng khối lượng của hạt nhân nguyên tử.
Nguyên tử và phân tử là hai khái niệm mà nhiều bạn vẫn mơ hồ. Bài viết sẽ phân biệt rõ ràng nguyên tử là gì và phân tử là gì để bạn không còn bị nhầm lẫn nữa. Phân biệt nguyên tử, phân tử qua những những điểm sau:
- Về định nghĩa: Phân tử là tập hợp gồm nhiều nguyên tử cấu tạo nên chất. Trong khi đó, nguyên tử còn là đơn vị nhỏ nhất của một nguyên tố tạo nên chất.
- Về trạng thái tồn tại: Phân tử tồn tại ở dạng tự do. Nguyên tử vừa có thể tồn tại ở trạng thái tự do, vừa không tồn tại ở trạng thái tự do.
- Về cấu tạo: Phân tử bao gồm hai hoặc nhiều hơn hai nguyên tử giống nhau trong cùng một nguyên tố. Nguyên tử có cấu tạo từ hai phần là hạt nhân (Proton, Notron) và Electron.
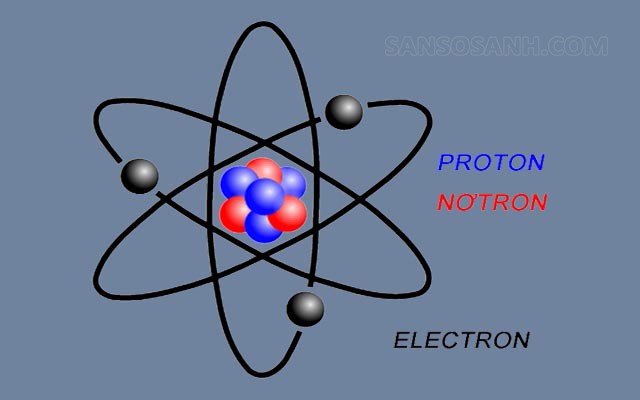
Cấu tạo của nguyên tử bao gồm phần hạt nhân và Electron
- Về hình dạng: Phân tử có thể tồn tại ở nhiều hình dạng khác nhau như dạng tuyến tính, dạng hình chữ nhật, dạng góc,... Trong khi đó, nguyên tử chỉ tồn tại ở dạng hình cầu.
- Về khả năng phản ứng: Phân tử có sự hạn chế về khả năng phản ứng, chúng không tham gia vào các phản ứng hóa học. Trái lại, nguyên tử lại có khả năng phản ứng rất cao, chúng tham gia vào các phản ứng hóa học.
- Về liên kết: Phân tử có liên kết cộng hóa trị: liên kết đơn, đôi và ba. Đối với nguyên tử, nó mang liên kết hạt nhân bởi vì nó kéo theo lực hút tĩnh điện giữa hạt nhân và Electron.
Những kiến thức về phân tử mặc dù đã được học nhưng không phải ai cũng có thể nắm chắc được. Mong rằng bài viết này của Sàn so sánh đã gợi lại cho bạn nhớ phân tử là gì và các kiến thức liên quan đến phân tử.